
2018年1月16日,美国化学学会著名期刊ACS AppliedMaterials & Interfaces(影响因子7.504)在线发表了澳门新葡官网进入网站8883狄留庆、乔宏志团队的最新研究成果“NanostructuredPeptidotoxins as Natural Pro-Oxidants Induced Cancer Cell Death viaAmplification of Oxidative Stress”。乔宏志副教授和2014级硕士方栋为共同第一作者,狄留庆教授为文章通讯作者。
动物毒肽是很多中药动物药的主要功效物质,具有药效活性强、作用机制明确等优势,但存在体内分布广、易代谢、毒副作用大的弊端,制约临床转化应用。众所周知,中药煎煮过程中,鞣质与蛋白成分会发生自沉淀现象。受此启发,课题组借鉴葡萄酒酿造工艺,仿生制备了聚多酚功能载体,并用于动物蛋白、毒肽类成分的纳米化和靶向递送。研究选取蜂毒肽(Mel)作为模型药物,与聚多酚(pEGCG)构建纳米复合物(NC),并将硼酸衍生化透明质酸(pHA)锚定在NC表面用于肿瘤主动识别。制备的pHA-NC可靶向至肿瘤,并被肿瘤高表达的透明质酸酶(HAase)降解暴露出内核,在Mel作用下逃逸出溶酶体进入细胞质。胞质内高活性氧(ROS)环境可触发硼酸酯键断裂和药物释放。作为天然助氧剂的Mel和pEGCG可进一步诱导ROS产生,使胞内ROS持续升高至耐受阈以上而致细胞死亡。该体系借鉴了中药制剂“药辅合一”的制药理念,pEGCG既可作为功能载体,又兼具药性,减少了辅料的使用。构建的ROS正反馈回路宛如一个智能动力泵,持续、可控地放大肿瘤细胞内的ROS信号,打破了肿瘤的内稳态,产生显著的肿瘤抑制效果。
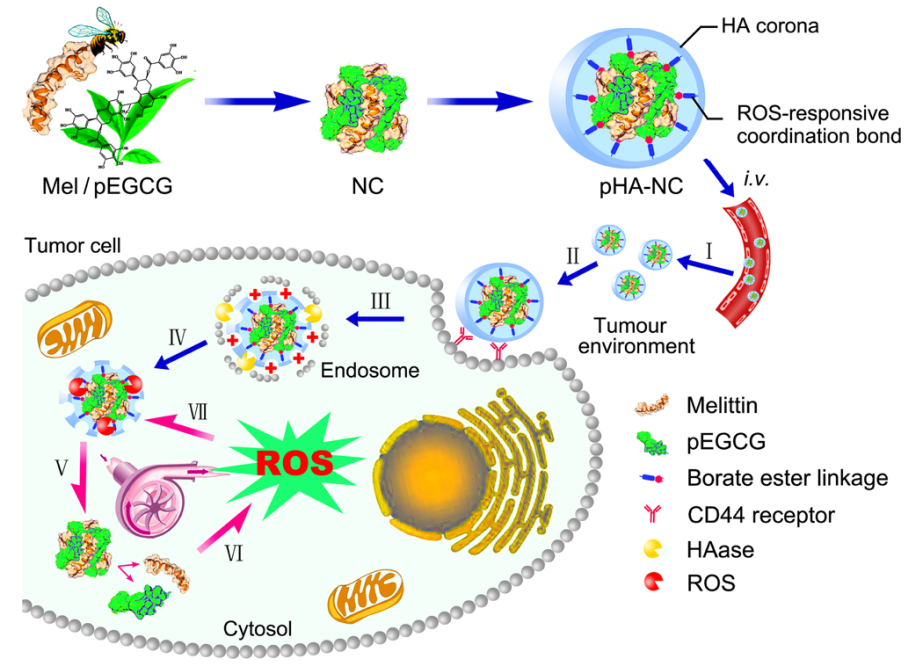
Fig 1. 纳米毒肽组装及胞内递送示意图
本研究为动物毒肽类药物的“无载体”纳米化制备和靶向递送提供了新的策略,同时为临床抗肿瘤氧化治疗方案的探索提供了一种新选择。该研究获得国家自然科学基金、江苏省自然科学基金、中国科协青年人才托举工程项目和江苏省优势学科项目等的资助。


